Sekce:
Denní přehled
Veřejná konzultace EK - e-návody ZP
Evropská komise zveřejnila k připomínkování novou inciativu týkající se elektronických návodů zdravotnických prostředků.
EK
24. 02. 2025
Sekce:
Denní přehled
Budoucnost péče o lidi se vzácným onemocněním
Dne 27. 2. 2025 se uskuteční Kulatý stůl na téma Budoucnost péče o lidi se vzácným onemocněním.
PSP ČR
17. 02. 2025
Sekce:
Denní přehled
Nový kardiologický plán pro období 2025 - 2035
MZ ČR představilo nový Národní kardiovaskulární plán pro období 2025–2035. Za cíl má posílit prevenci a snížit podíl Čechů s nemocemi srdce a cév.
MZ ČR
17. 02. 2025
Sekce:
Denní přehled
Tichá epidemie - Dramatický vzestup neurologických a neurodegenerativních onemocnění v ČR
Dne 13. 3. 2025 se uskuteční konference na téma: Tichá epidemie - Dramatický vzestup neurologických a neurodegenerativních onemocnění v ČR
PSP ČR
17. 02. 2025
Sekce:
Denní přehled
Aktualizace pokynu SÚKL
SÚKL aktualizoval pokyny týkající se komunikace související se závadou v jakosti léků.
SÚKL
05. 02. 2025
Sekce:
Denní přehled
Notifikační e-maily z ISZP
SÚKL informuje o notifikačních emailehc upozorňujících na konec platnosti činnosti v ISZP.
SÚKL
05. 02. 2025
Sekce:
Zaměřeno na
Informacím vstříc
Vliv rozhodovací praxe Státního ústavu pro kontrolu léčiv i Ministerstva zdravotnictví v oblasti cen a úhrad je zásadní pro každou farmaceutickou společnost, která chce uspět na českém trhu. Proto...
Pharmeca a.s.
04. 02. 2025
Sekce:
Zaměřeno na
Informační systém klinických studií (CTIS) v plném provozu
Informační systém klinických hodnocení (CTIS) je od 30. 1. 2025 jediným vstupním místem pro předkládání a hodnocení žádostí o klinická hodnocení v EU.
EMA
04. 02. 2025
Sekce:
Denní přehled
Veřejná konzultace EK - kriticky důležitá léčiva
Evropská komise zveřejnila k připomínkování novou inciativu týkající se dodavatelského řetězce kriticky důležitých léčiv.
EK
03. 02. 2025
Sekce:
Denní přehled
Spouštění nové platformy pro monitorování nedostatku léčiv
Evropská léková agentura upozorňuje na povinnost držitelů využívat novou platformu sloužící k monitorování nedostatku centrálně registrovaných léčivých přípravků.
Pharmeca a.s.
31. 01. 2025
Sekce:
Denní přehled
Veřejná konzultace EK - Master UDI-DI
Evropská komise zveřejnila k připomínkování novou inciativu týkající se Master UDI-DI u zdravotnických prostředků.
EK
31. 01. 2025
Sekce:
Denní přehled
Aktualizace pokynů SÚKL
SÚKL aktualizoval pokyny týkající se správních poplatků a náhrad výdajů za odborné úkony.
SÚKL
27. 01. 2025
Sekce:
Denní přehled
Proces péče o pacienty s poruchou metabolismu tuků
Dne 4. 2. 2025 se uskuteční kulatý stůl na téma Proces péče o pacienty s poruchou metabolismu tuků.
PSP ČR
24. 01. 2025
Sekce:
Denní přehled
SÚKL informuje o PMFC zkouškách u zdravotnických prostředků
SÚKL upozorňuje na oznamovací povinnost zadavatelů provádějících PMCF zkoušku, která zahrnuje vystavení subjektů jiným postupům, než jaké se provádějí za běžných podmínek použití prostředku.
SÚKL
17. 01. 2025
Sekce:
Denní přehled
Aktualizace pokynu CAU-13
SÚKL aktualizoval pokyn týkající se postupu klinického hodnocení léčivých přípravků/PZLÚ pro účely úhradové regulace.
SÚKL
16. 01. 2025
Sekce:
Vizualizace dat
Kalendář vybraných akcí ve zdravotnictví
Společnost Pharmeca a.s. připravila výběr vzdělávacích akcí v oblasti zdravotnictví se zaměřením na oblast léků a zdravotnických prostředků.
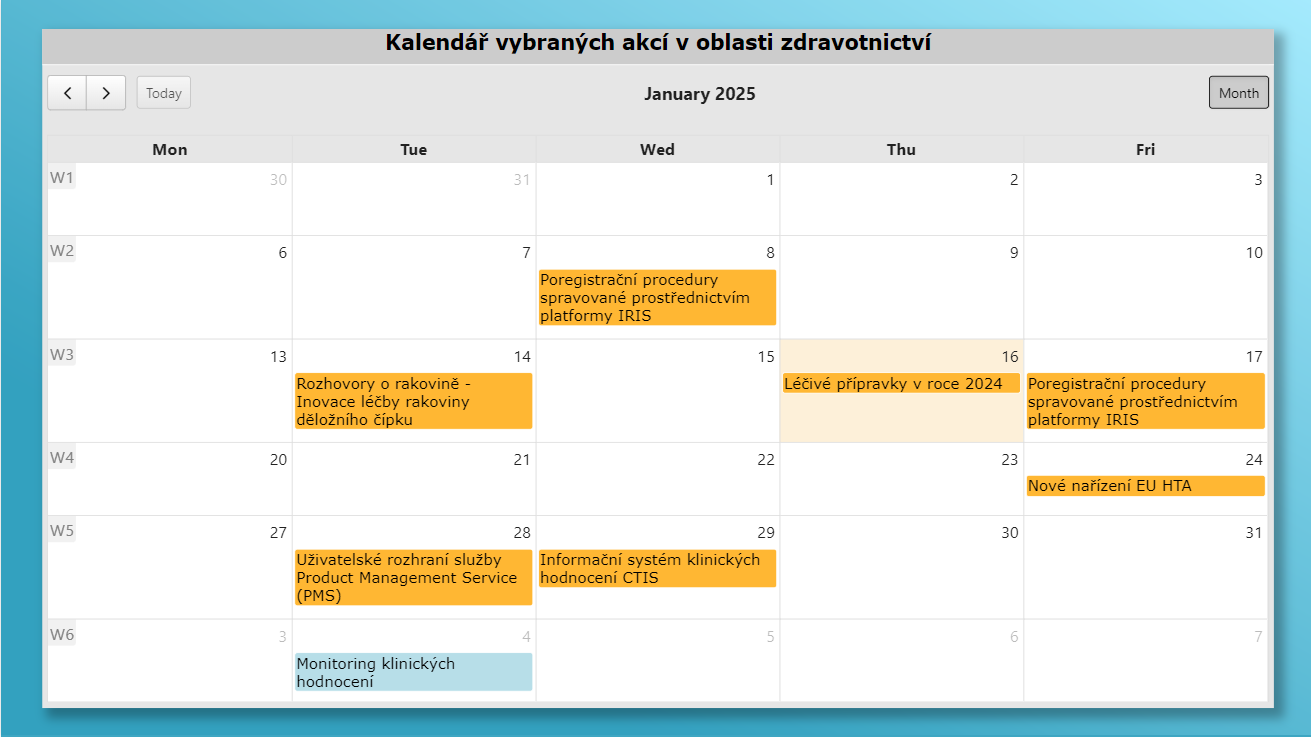

Pharmeca a.s.
13. 01. 2025

