Sekce:
Denní přehled
Veřejná konzultace EMA - léky založené na mikrobiomu
EMA zahájila veřejnou konzultaci návrhu dokumentu zaměřeného na vývoj a hodnocení léčivých přípravků založených na mikrobiomu.
EMA
04. 03. 2026
Sekce:
Denní přehled
Výběr z rozhodovací praxe – 4/2026
Tendrové ceny v cenové referenci.
Pharmeca a.s.
04. 03. 2026
Sekce:
Denní přehled
Formuláře PZLÚ
SÚKL zveřejnil formuláře pro ohlášení kategorizovaných potravin pro zvláštní lékařské účely dle zákona o veřejném zdravotním pojištění.
SÚKL
27. 02. 2026
Sekce:
Zaměřeno na
Léčiva pro vzácná onemocnění z pohledu rozhodovací praxe
V roce 2025 vydal SÚKL na základě závazného stanoviska MZ ČR celkem 12 pravomocných rozhodnutí v řízeních týkajících se stanovení úhrady a ceny u léčiv pro vzácná onemocnění.
Pharmeca a.s.
27. 02. 2026
Sekce:
Denní přehled
Pokyny k ohlášení PZLÚ
SÚKL zveřejnil pokyn CAU-17, CAU-18 a CAU-19 k různým typů ohlášení u potravin pro zvláštní lékařské účely.
SÚKL
27. 02. 2026
Sekce:
Denní přehled
Za léčbu vzácných chorob vydá VZP ročně miliardy korun
VZP zveřejnila tiskovou zprávu u příležitosti Mezinárodního dne boje proti vzácným chorobám.
VZP
26. 02. 2026
Sekce:
Denní přehled
Informace k distribuci léčivých přípravků do zahraničí
SÚKL zveřejnil informaci pro distributory provádějící distribuci léčivých přípravků do zahraničí.
SÚKL
18. 02. 2026
Sekce:
Denní přehled
Výběr z rozhodovací praxe – 3/2026
Stanovení úhrady za účelem zajištění dostupnosti.
Pharmeca a.s.
18. 02. 2026
Sekce:
Denní přehled
Veřejná konzultace EMA - myasthenie gravis
EMA zahájila veřejnou konzultaci návrhu dokumentu zaměřeného na klinické hodnocení léčivých přípravků v léčbě myasthenia gravis.
EMA
16. 02. 2026
Sekce:
Denní přehled
Seminář SÚKL 8/2026 - FV
Seminář SÚKL na téma - Základy farmakovigilance.
SÚKL
12. 02. 2026
Sekce:
Denní přehled
Možné výpadky služeb Verso a DSŘ
SÚKL upozorňuje na možné omezení dálkového nahlížení do spisů přes aplikaci Verso a automatizovaného přístupu k dokumentům správních řízení CAU.
SÚKL
09. 02. 2026
Sekce:
Denní přehled
Výběr z rozhodovací praxe – 2/2026
Posuzovaná kritéria pro první podobný přípravek.
Pharmeca a.s.
04. 02. 2026
Sekce:
Denní přehled
Nový pokynu CAU-16
SÚKL zveřejnil pokyn CAU-16 Pokyny pro vyplnění žádosti o hodnocení přínosů a nákladů u léčivých přípravků, které lze používat pouze při lůžkové péči.
SÚKL
02. 02. 2026
Sekce:
Denní přehled
Veřejná konzultace EMA - Bayesovská statistika v klinickém vývoji
EMA zahájila veřejnou konzultaci návrhu dokumentu zaměřeného na využití Bayesovských metod v klinickém vývoji.
EMA
02. 02. 2026
Sekce:
Denní přehled
Zdraví populace – hledání politické shody na směřování změn
Výbor pro zdravotnictví PSP ČR pořádá konferenci Zdraví populace – hledání politické shody na směřování změn.
PSP ČR
02. 02. 2026
Sekce:
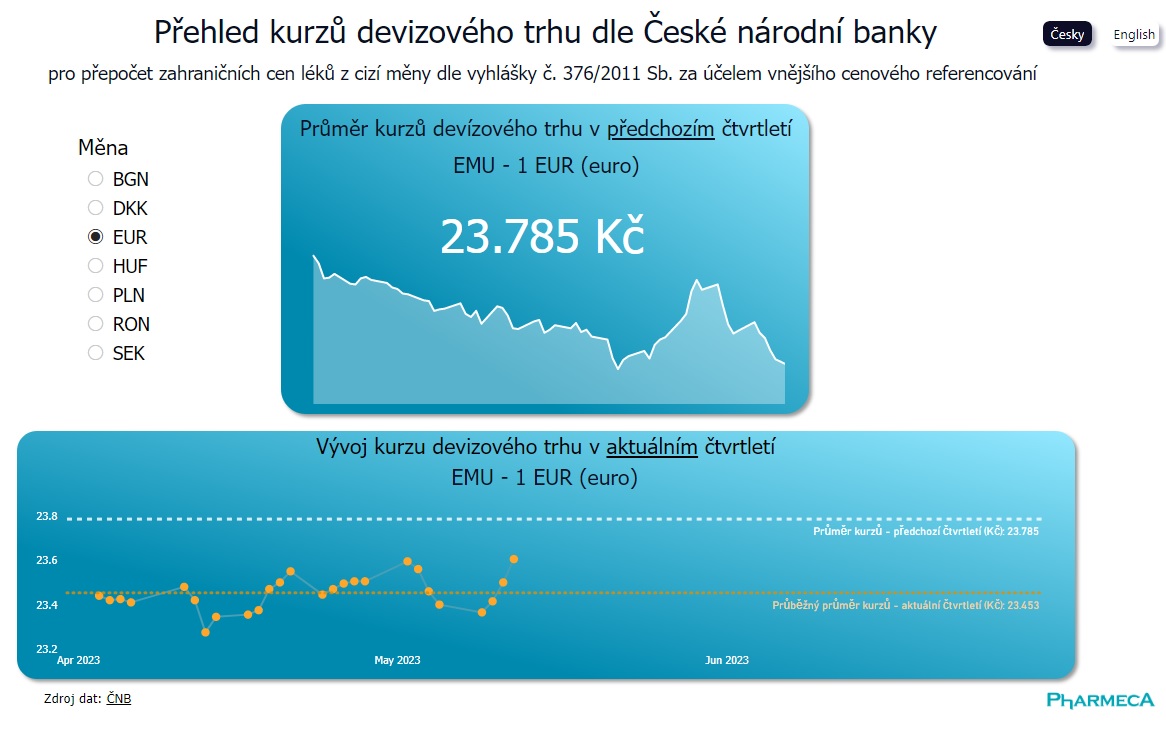
Vizualizace dat
Kurzy pro cenovou referenci na klik
Základní informací pro provedení cenové reference v řízení o stanovení cen a úhrad léků je průměrný směnný kurz v předchozím čtvrtletí. Nově si přehled všech potřebných směnných kurzů můžete najít...

Pharmeca a.s.
28. 01. 2026

