Sekce:
Denní přehled
Výběr z rozhodovací praxe – 2/2026
Posuzovaná kritéria pro první podobný přípravek.
Pharmeca a.s.
04. 02. 2026
Sekce:
Denní přehled
Zdraví populace – hledání politické shody na směřování změn
Výbor pro zdravotnictví PSP ČR pořádá konferenci Zdraví populace – hledání politické shody na směřování změn.
PSP ČR
02. 02. 2026
Sekce:
Vizualizace dat
Kurzy pro cenovou referenci na klik
Základní informací pro provedení cenové reference v řízení o stanovení cen a úhrad léků je průměrný směnný kurz v předchozím čtvrtletí. Nově si přehled všech potřebných směnných kurzů můžete najít...
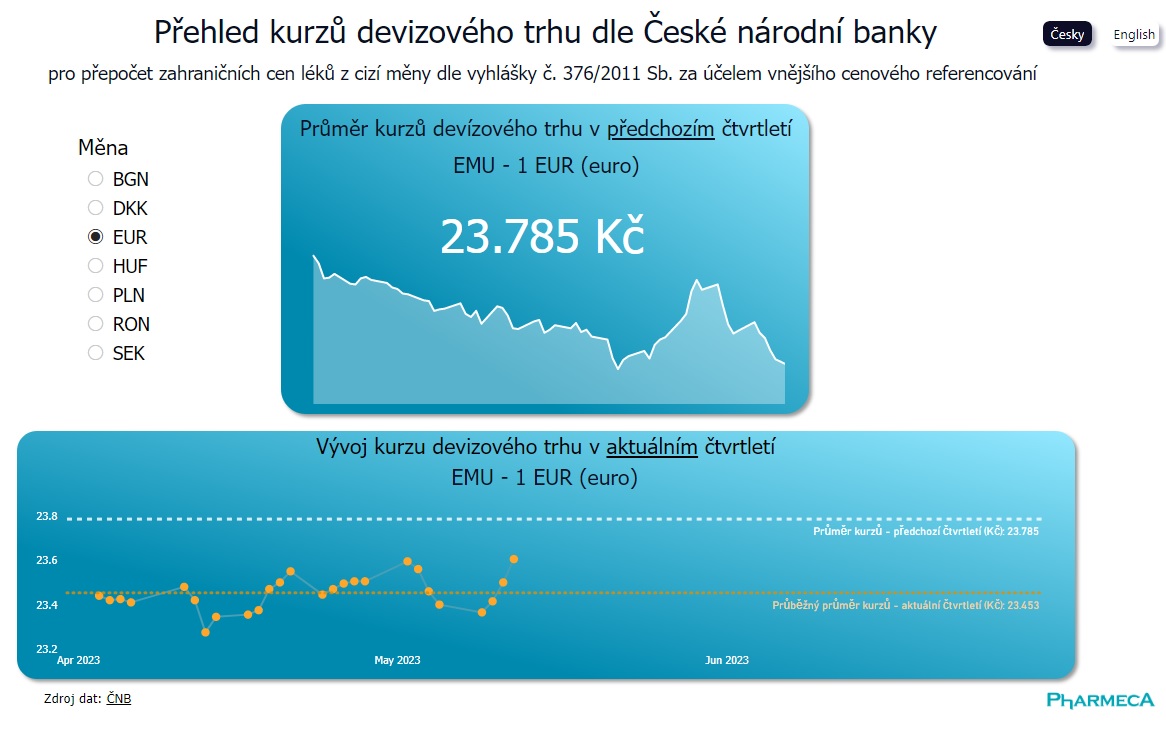

Pharmeca a.s.
28. 01. 2026
Sekce:
Zaměřeno na
Kurzy pro cenovou referenci po novele
Novela zákona o veřejném zdravotním pojištění a prováděcích vyhlášek přinesla od nového roku změny i v oblasti práce se směnnými kurzy pro cenovou referenci.
Pharmeca a.s.
28. 01. 2026
Sekce:
Denní přehled
Výběr z rozhodovací praxe – 1/2026
Zajištění plně hrazeného přípravku - typově stejné onemocnění.
Pharmeca a.s.
14. 01. 2026
Sekce:
Denní přehled
Cesta ke zdraví – onkologie 2025
Výbor pro zdravotnictví PSP ČR pořádá kulatý stůl Cesta ke zdraví – onkologie 2025.
PSP ČR
12. 01. 2026
Sekce:
Zaměřeno na
Připravovaná změna pravidel hry ve farmacii
Shrnutí informací o průlomových legislativních krocích, ke kterým bylo přikročeno v roce 2025 na úrovni EU.
Pharmeca a.s.
07. 01. 2026
Sekce:
Zaměřeno na
Česká právní úprava
Aktuální přehled vybraných českých právních předpisů týkající se léků a zdravotnických prostředků.
Pharmeca
30. 12. 2025

