Sekce:
Zaměřeno na
Informační systém klinických studií (CTIS) v plném provozu
Informační systém klinických hodnocení (CTIS) je od 30. 1. 2025 jediným vstupním místem pro předkládání a hodnocení žádostí o klinická hodnocení v EU.
EMA
04. 02. 2025
Sekce:
Denní přehled
Veřejná konzultace EK - kriticky důležitá léčiva
Evropská komise zveřejnila k připomínkování novou inciativu týkající se dodavatelského řetězce kriticky důležitých léčiv.
EK
03. 02. 2025
Sekce:
Denní přehled
Spouštění nové platformy pro monitorování nedostatku léčiv
Evropská léková agentura upozorňuje na povinnost držitelů využívat novou platformu sloužící k monitorování nedostatku centrálně registrovaných léčivých přípravků.
Pharmeca a.s.
31. 01. 2025
Sekce:
Denní přehled
Veřejná konzultace EK - Master UDI-DI
Evropská komise zveřejnila k připomínkování novou inciativu týkající se Master UDI-DI u zdravotnických prostředků.
EK
31. 01. 2025
Sekce:
Denní přehled
Proces péče o pacienty s poruchou metabolismu tuků
Dne 4. 2. 2025 se uskuteční kulatý stůl na téma Proces péče o pacienty s poruchou metabolismu tuků.
PSP ČR
24. 01. 2025
Sekce:
Vizualizace dat
Kalendář vybraných akcí ve zdravotnictví
Společnost Pharmeca a.s. připravila výběr vzdělávacích akcí v oblasti zdravotnictví se zaměřením na oblast léků a zdravotnických prostředků.
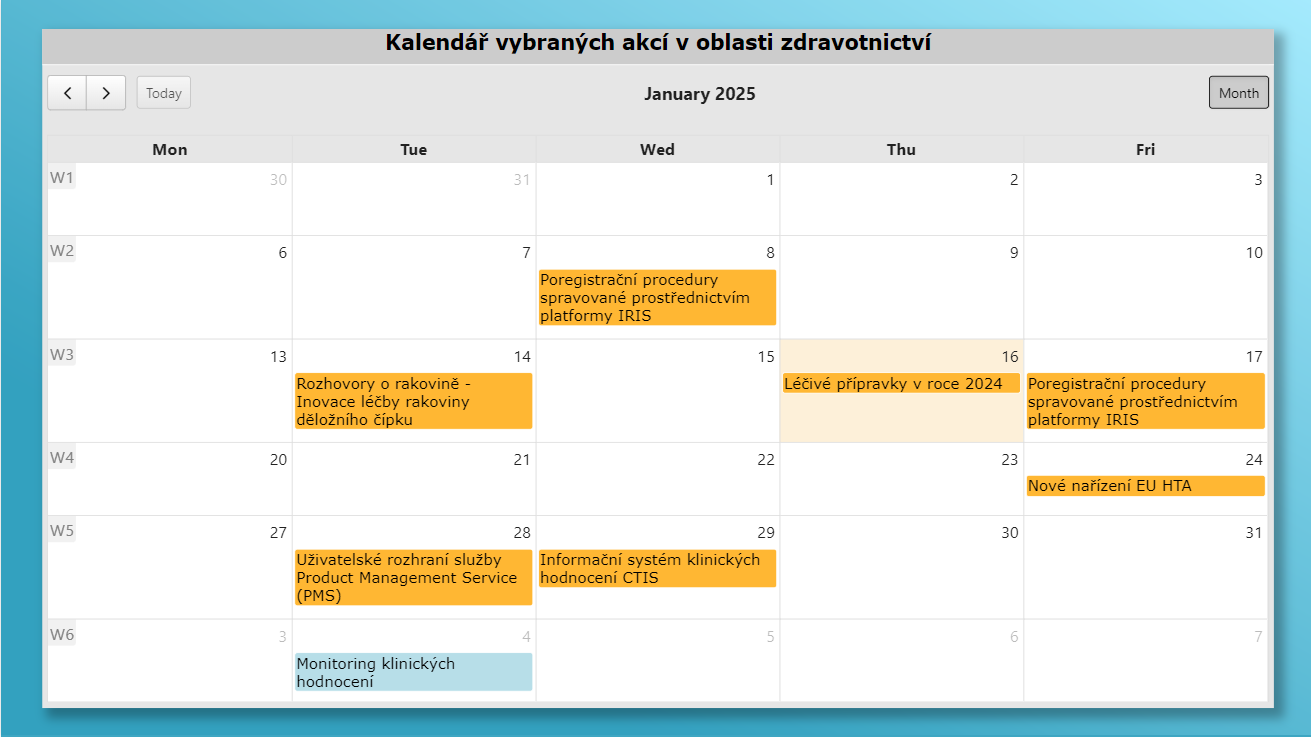

Pharmeca a.s.
13. 01. 2025
Sekce:
Vizualizace dat
Rozhodnutí SÚKL a MZ ČR v oblasti cen a úhrad
Od 1. 1. 2025 nabízí společnost Pharmeca a.s. na svých stránkách přehled vydaných rozhodnutí SÚKL a MZ ČR v oblasti cen a úhrad.
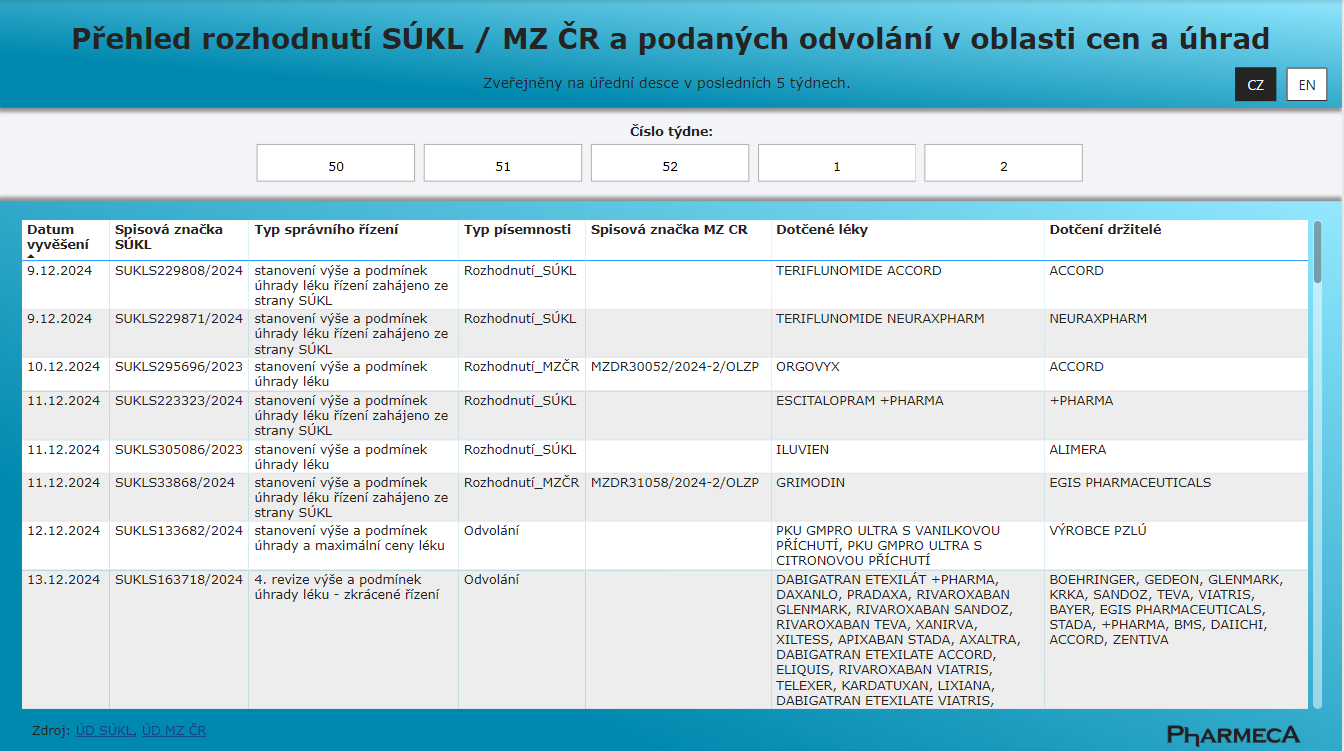

Pharmeca a.s.
08. 01. 2025
Sekce:
Denní přehled
Vyjádření MZ ČR k otázce distribuce do zahraničí
Pharmeca a. s. upozorňuje výrobce, držitele rozhodnutí o registraci a distributory na vyjádření Ministerstva zdravotnictví ČR k otázce zákazu distribuce do zahraničí.
MZ ČR
06. 01. 2025

