Sekce:
Denní přehled
Výběr z rozhodovací praxe – 2/2026
Posuzovaná kritéria pro první podobný přípravek.
Pharmeca a.s.
04. 02. 2026
Sekce:
Denní přehled
Nový pokynu CAU-16
SÚKL zveřejnil pokyn CAU-16 Pokyny pro vyplnění žádosti o hodnocení přínosů a nákladů u léčivých přípravků, které lze používat pouze při lůžkové péči.
SÚKL
02. 02. 2026
Sekce:
Denní přehled
Veřejná konzultace EMA - Bayesovská statistika v klinickém vývoji
EMA zahájila veřejnou konzultaci návrhu dokumentu zaměřeného na využití Bayesovských metod v klinickém vývoji.
EMA
02. 02. 2026
Sekce:
Denní přehled
Zdraví populace – hledání politické shody na směřování změn
Výbor pro zdravotnictví PSP ČR pořádá konferenci Zdraví populace – hledání politické shody na směřování změn.
PSP ČR
02. 02. 2026
Sekce:
Vizualizace dat
Kurzy pro cenovou referenci na klik
Základní informací pro provedení cenové reference v řízení o stanovení cen a úhrad léků je průměrný směnný kurz v předchozím čtvrtletí. Nově si přehled všech potřebných směnných kurzů můžete najít...
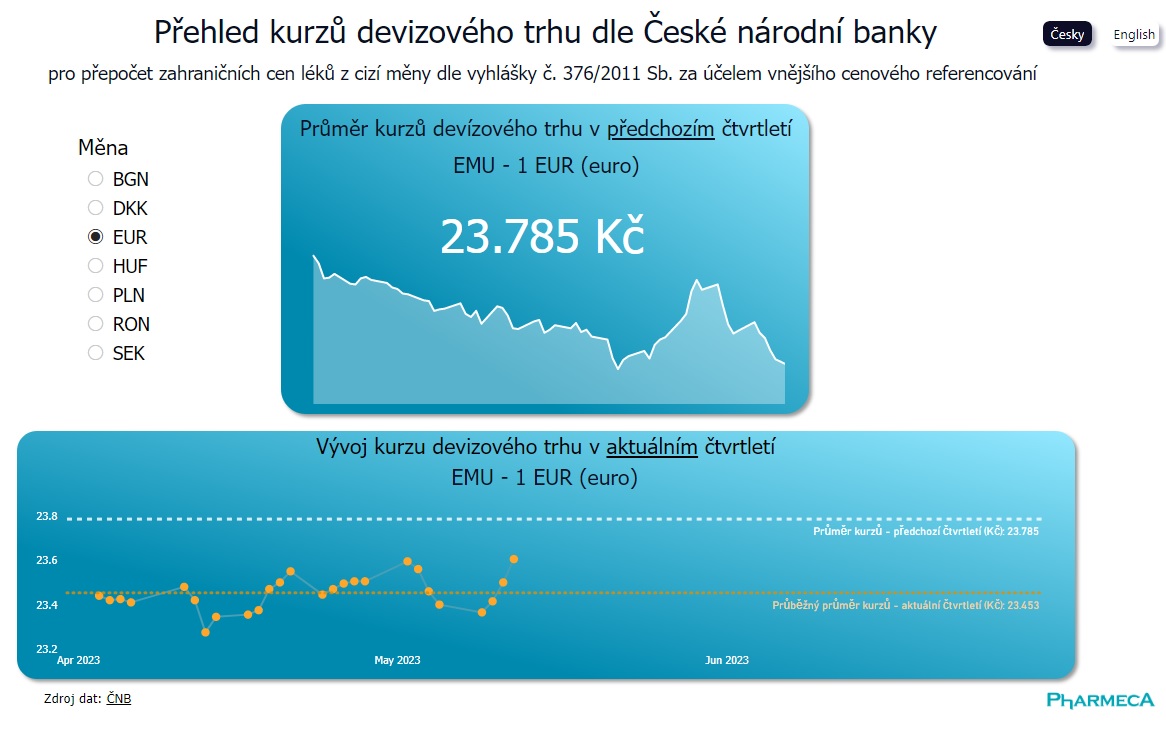

Pharmeca a.s.
28. 01. 2026
Sekce:
Zaměřeno na
Kurzy pro cenovou referenci po novele
Novela zákona o veřejném zdravotním pojištění a prováděcích vyhlášek přinesla od nového roku změny i v oblasti práce se směnnými kurzy pro cenovou referenci.
Pharmeca a.s.
28. 01. 2026
Sekce:
Denní přehled
Veřejná konzultace EMA - kardiovaskulární bezpečnost onkologik
EMA zahájila veřejnou konzultaci návrhu dokumentu zaměřeného na výzkum a hodnocení kardiovaskulární bezpečnosti protinádorových léčiv.
EMA
23. 01. 2026
Sekce:
Denní přehled
Změny v ATC skupinách
SÚKL informuje o novém rozdělení léčivých látek do ATC skupin souvisejícím s vydáním aktualizované verze ATC/DDD Indexu platné od 1. 1. 2026.
SÚKL
20. 01. 2026

