Sekce:
Vizualizace dat
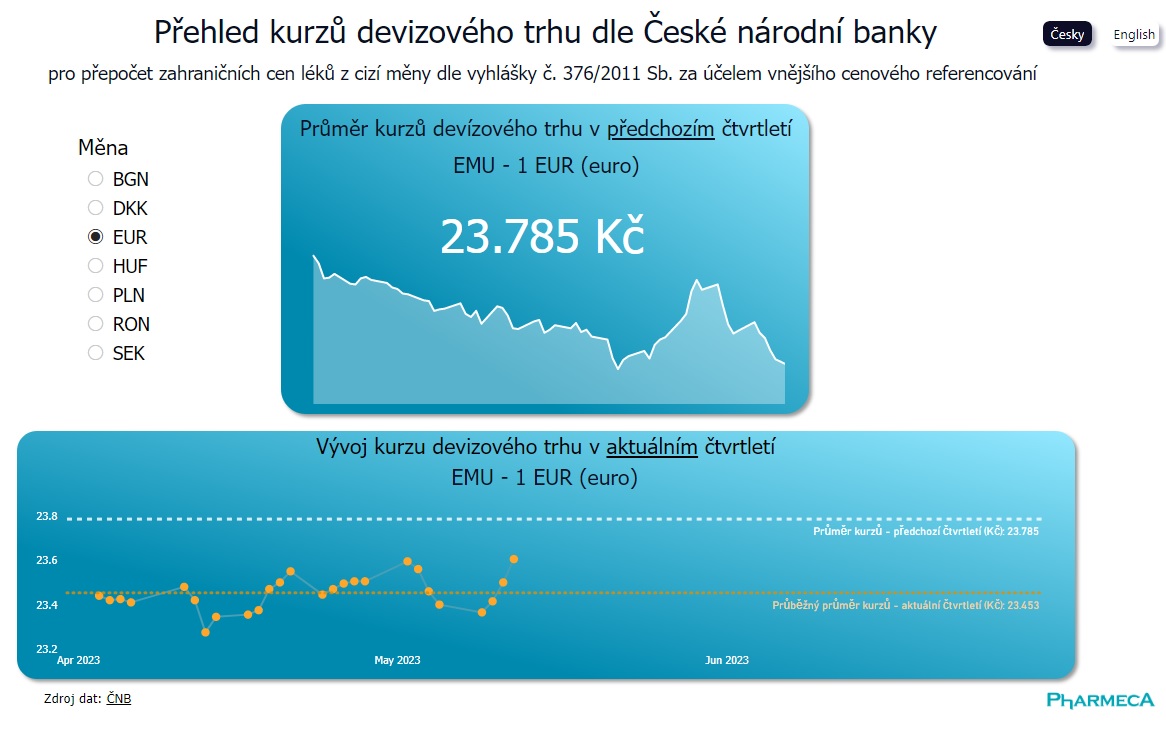
Kurzy pro cenovou referenci na klik
Základní informací pro provedení cenové reference v řízení o stanovení cen a úhrad léků je průměrný směnný kurz v předchozím čtvrtletí. Nově si přehled všech potřebných směnných kurzů můžete najít...

Pharmeca a.s.
28. 01. 2026
Sekce:
Zaměřeno na
Kurzy pro cenovou referenci po novele
Novela zákona o veřejném zdravotním pojištění a prováděcích vyhlášek přinesla od nového roku změny i v oblasti práce se směnnými kurzy pro cenovou referenci.
Pharmeca a.s.
28. 01. 2026
Sekce:
Denní přehled
Veřejná konzultace EMA - kardiovaskulární bezpečnost onkologik
EMA zahájila veřejnou konzultaci návrhu dokumentu zaměřeného na výzkum a hodnocení kardiovaskulární bezpečnosti protinádorových léčiv.
EMA
23. 01. 2026
Sekce:
Denní přehled
Změny v ATC skupinách
SÚKL informuje o novém rozdělení léčivých látek do ATC skupin souvisejícím s vydáním aktualizované verze ATC/DDD Indexu platné od 1. 1. 2026.
SÚKL
20. 01. 2026
Sekce:
Denní přehled
Aktualizace metodiky SÚKL - referenční ceny 1/2026
SÚKL aktualizoval metodiku přepočtu nalezené ceny na cenu referenční.
SÚKL
19. 01. 2026
Sekce:
Denní přehled
Aktualizace seznamu referenčních zdrojů SÚKL
SÚKL aktualizoval seznam veřejně dostupných referenčních zdrojů cen léčiv a potravin pro zvláštní lékařské účely používaných pro účely cenové a úhradové regulace.
SÚKL
19. 01. 2026
Sekce:
Denní přehled
Nový pokynu CAU-15
SÚKL zveřejnil pokyn CAU-15 Požadavky na strukturu odborných podkladů doplňujících žádost o hodnocení nákladů a přínosů léčivých přípravků používaných pouze při poskytování ústavní péče, příp. na...
SÚKL
19. 01. 2026
Sekce:
Denní přehled
Aktualizace pokynu CAU-08 v4
SÚKL aktualizoval pokyn CAU-08 Požadavky na strukturu odborných podkladů doplňujících žádost a na strukturu vyjádření ostatních účastníků při předkládání důkazů v řízeních o stanovení nebo změnu...
SÚKL
16. 01. 2026

