Sekce:
Denní přehled
Informace k distribuci léčivých přípravků do zahraničí
SÚKL zveřejnil informaci pro distributory provádějící distribuci léčivých přípravků do zahraničí.
SÚKL
18. 02. 2026
Sekce:
Denní přehled
Výběr z rozhodovací praxe – 3/2026
Stanovení úhrady za účelem zajištění dostupnosti.
Pharmeca a.s.
18. 02. 2026
Sekce:
Denní přehled
Veřejná konzultace EMA - myasthenie gravis
EMA zahájila veřejnou konzultaci návrhu dokumentu zaměřeného na klinické hodnocení léčivých přípravků v léčbě myasthenia gravis.
EMA
16. 02. 2026
Sekce:
Denní přehled
Seminář SÚKL 8/2026 - FV
Seminář SÚKL na téma - Základy farmakovigilance.
SÚKL
12. 02. 2026
Sekce:
Denní přehled
Možné výpadky služeb Verso a DSŘ
SÚKL upozorňuje na možné omezení dálkového nahlížení do spisů přes aplikaci Verso a automatizovaného přístupu k dokumentům správních řízení CAU.
SÚKL
09. 02. 2026
Sekce:
Denní přehled
Výběr z rozhodovací praxe – 2/2026
Posuzovaná kritéria pro první podobný přípravek.
Pharmeca a.s.
04. 02. 2026
Sekce:
Denní přehled
Nový pokynu CAU-16
SÚKL zveřejnil pokyn CAU-16 Pokyny pro vyplnění žádosti o hodnocení přínosů a nákladů u léčivých přípravků, které lze používat pouze při lůžkové péči.
SÚKL
02. 02. 2026
Sekce:
Denní přehled
Veřejná konzultace EMA - Bayesovská statistika v klinickém vývoji
EMA zahájila veřejnou konzultaci návrhu dokumentu zaměřeného na využití Bayesovských metod v klinickém vývoji.
EMA
02. 02. 2026
Sekce:
Denní přehled
Zdraví populace – hledání politické shody na směřování změn
Výbor pro zdravotnictví PSP ČR pořádá konferenci Zdraví populace – hledání politické shody na směřování změn.
PSP ČR
02. 02. 2026
Sekce:
Vizualizace dat
Kurzy pro cenovou referenci na klik
Základní informací pro provedení cenové reference v řízení o stanovení cen a úhrad léků je průměrný směnný kurz v předchozím čtvrtletí. Nově si přehled všech potřebných směnných kurzů můžete najít...
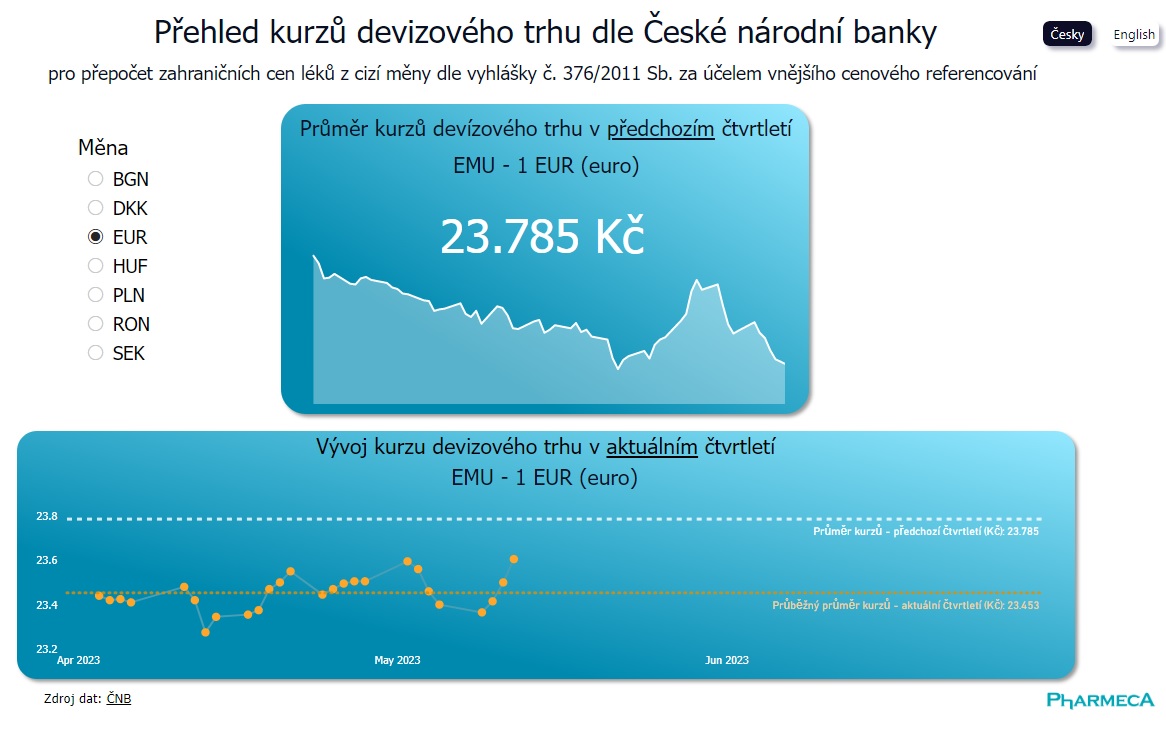

Pharmeca a.s.
28. 01. 2026
Sekce:
Zaměřeno na
Kurzy pro cenovou referenci po novele
Novela zákona o veřejném zdravotním pojištění a prováděcích vyhlášek přinesla od nového roku změny i v oblasti práce se směnnými kurzy pro cenovou referenci.
Pharmeca a.s.
28. 01. 2026
Sekce:
Denní přehled
Veřejná konzultace EMA - kardiovaskulární bezpečnost onkologik
EMA zahájila veřejnou konzultaci návrhu dokumentu zaměřeného na výzkum a hodnocení kardiovaskulární bezpečnosti protinádorových léčiv.
EMA
23. 01. 2026
Sekce:
Denní přehled
Úpozornění SÚKL k elastoviskózním roztokům.
Upozornění SÚKL ke změnám ohlašování elastoviskózních roztoků do systému úhrad.
SÚKL
21. 01. 2026
Sekce:
Denní přehled
Změny v ATC skupinách
SÚKL informuje o novém rozdělení léčivých látek do ATC skupin souvisejícím s vydáním aktualizované verze ATC/DDD Indexu platné od 1. 1. 2026.
SÚKL
20. 01. 2026
Sekce:
Denní přehled
Aktualizace metodiky SÚKL - referenční ceny 1/2026
SÚKL aktualizoval metodiku přepočtu nalezené ceny na cenu referenční.
SÚKL
19. 01. 2026
Sekce:
Denní přehled
Aktualizace seznamu referenčních zdrojů SÚKL
SÚKL aktualizoval seznam veřejně dostupných referenčních zdrojů cen léčiv a potravin pro zvláštní lékařské účely používaných pro účely cenové a úhradové regulace.
SÚKL
19. 01. 2026

